提示
亲和层析之蛋白A
2021-12-28

近年来,生物制药发展迅速,尤其是单克隆抗体药物以其高特异性、有效性和安全性逐渐成为癌症及其他疾病治疗市场的新宠。规模化抗体药物生产在我国仍有许多问题要解决,而纯化环节也及其重要,直接关系到抗体药物的质量、安全性、成本等多个方面。典型的抗体纯化过程首先通过蛋白A亲和层析对抗体进行捕获。其中功能配基是天然蛋白Protein A,来源于金黄色葡萄球菌的细胞壁,与IgG的Fc片段具有非常强的特异性,分子量约为42×103,如图所示。一般在蛋白 A亲和层析中,配基在中性pH条件下结合抗体,在酸性pH条件下与蛋白解离。
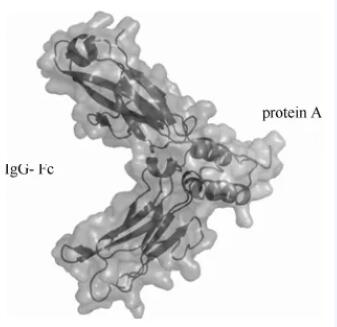
蛋白A与抗体IgG的Fc片段结合模式
基于蛋白 A 亲和层析的抗体捕获工艺较为稳定,但也存在一些不足,主要包括:
(1)介质成本高。
(2)配基易脱落。
(3)洗脱条件苛刻。
(4)Protein A介质的再生比较困难。
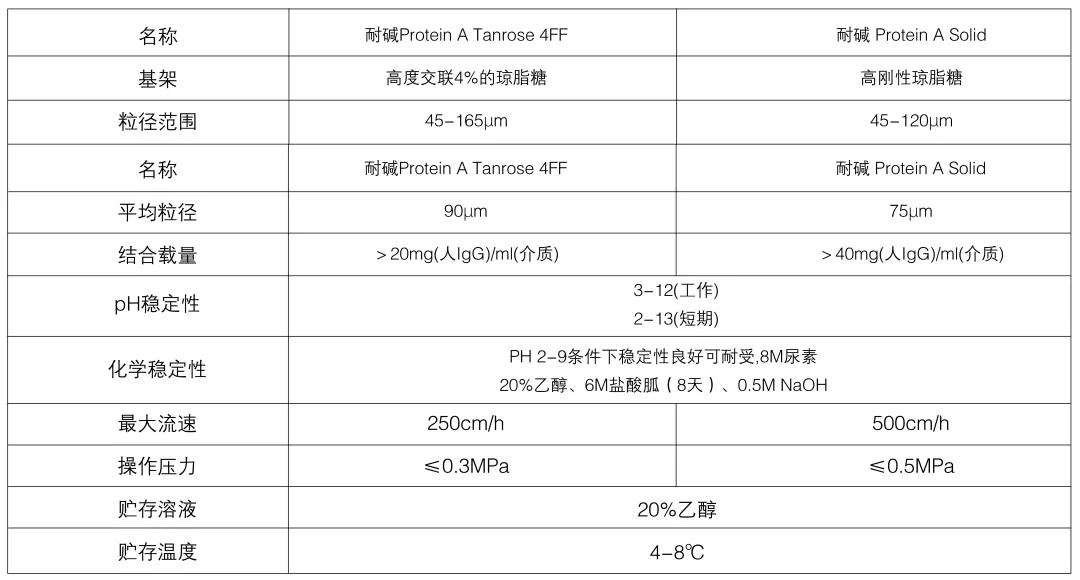
针对以上问题,部分商业化蛋白A亲和层析介质中使用的基本为改造的蛋白A配基,改善了天然蛋白A的缺点,提高了耐碱能力和洗脱 pH。月旭科技推出的耐碱抗体亲和介质-耐碱Protein A Solid/耐碱Protein A 4FF, 由大肠杆菌表达,经层析纯化获得,纯化过程不适用抗体柱亲和层析,避免了产品中掺入无关IgG的可能,改配基pH耐受0.5M NaOH和0.5M HCl处理,不降解,抗体结合能力不变。该介质适合从大批培养液捕获单克隆抗体或Fc融合蛋白,也适合与从腹水或者血浆中捕获多克隆抗体。
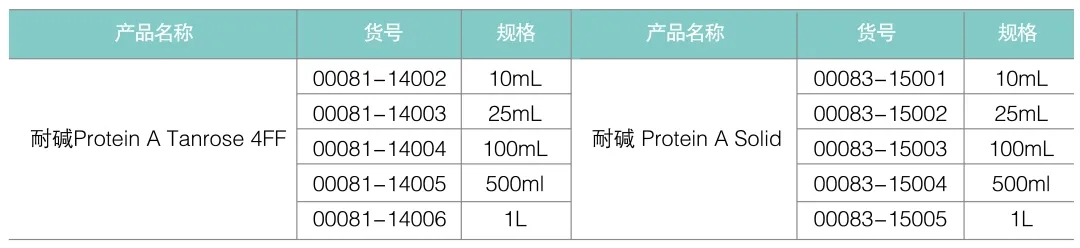
技术参数
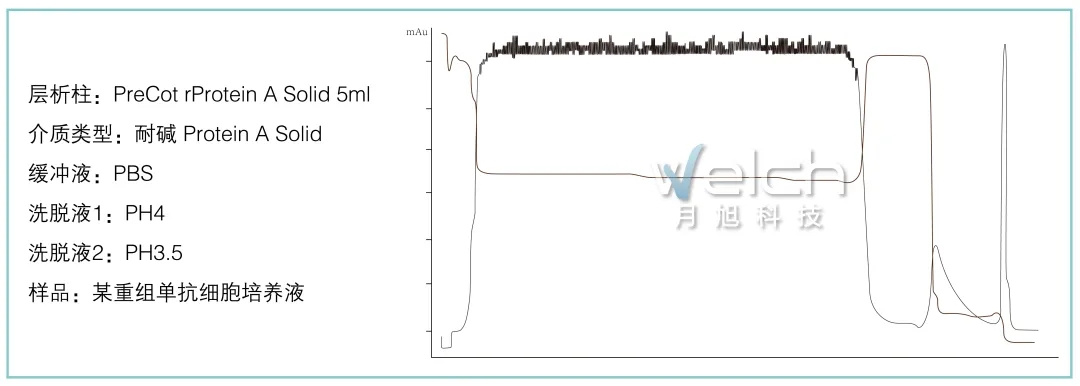
应用实例
订货信息